Câu 9. Cho 16 gam CuO tác dụng vừa đủ với m gam dung dịch HCl 20%, sau phản ứng thu được dung dịch X. (a) Viết phương trình hóa học xảy ra. (b) Tính m. (c) Tính nồng độ phần trăm của chất có trong dung dịch X.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(m_{FeCl_3}=\dfrac{100\cdot13\%}{100\%}=13\left(g\right)\\ \Rightarrow n_{FeCl_3}=\dfrac{13}{162,5}=0,08\left(mol\right)\\ a,\text{Hiện tượng: Màu vàng nâu của dung dịch }FeCl_3\text{ nhạt dần và xuất hiện kết tủa màu nâu đỏ }Fe\left(OH\right)_3\\ PTHH:3NaOH+FeCl_3\rightarrow Fe\left(OH\right)_3\downarrow+3NaCl\\ \Rightarrow n_{NaOH}=3n_{FeCl_3}=0,24\left(mol\right)\\ \Rightarrow m_{CT_{NaOH}}=0,24\cdot40=9,6\left(g\right)\\ \Rightarrow m_{dd_{NaOH}}=\dfrac{9,6\cdot100\%}{10\%}=96\left(g\right)\)\(b,n_{Fe\left(OH\right)_3}=0,08\left(mol\right);n_{NaCl}=0,24\left(mol\right)\\ \Rightarrow\left\{{}\begin{matrix}m_{Fe\left(OH\right)_3}=0,08\cdot107=8,56\left(g\right)\\m_{NaCl}=0,24\cdot58,5=14,04\left(g\right)\end{matrix}\right.\\ \Rightarrow m_{dd_{NaCl}}=96+100-8,56=187,44\left(g\right)\\ \Rightarrow C\%_{NaCl}=\dfrac{14,04}{187,44}\cdot100\%\approx7,49\%\)

nZn=0,1 mol
Zn +2HCl=> ZnCl2+ H2
0,1 mol =>0,2 mol
=>mHCl=36,5.0,2=7,3g
=>m dd HCl=7,3/14,6%=50g
mdd sau pứ=6,5+50-0,1.2=56,3g
=>C% dd ZnCl2=(0,1.136)/56,3.100%=24,16%
a.b. Zn + 2HCl ---> ZnCl2 + H2 (1)
Theo pt: 65g 73g 136g 2g
Theo đề: 6,5g 7,3g 13,6g
=> mddHCl=\(\frac{7,3.100}{14,6}=50\left(g\right)\)
c. Từ pt (1), ta có: \(C_{\%}=\frac{13,6}{50+6,5}.100\%=24,1\%\)
![]()

a.b.\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,1 0,3 0,2 ( mol )
\(V_{H_2}=0,3.22,4=6,72l\)
c.\(n_{HCl}=\dfrac{125.14,6\%}{36,5}=0,5mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,2 < 0,5 ( mol )
0,2 0,2 0,2 ( mol )
\(m_{FeCl_2}=0,2.127=25,4g\)
\(m_{ddspứ}=\left(0,2.56\right)+125-0,2.2=135,8g\)
\(C\%_{FeCl_2}=\dfrac{25,4}{135,8}.100=18,7\%\)
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\:\right)\\
Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
0,1 0,3 0,2
=> \(m_{H_2}=0,3.22,4=6,72\left(l\right)\)
\(m_{HCl}=125.14,6\%=18,25\left(g\right)\)
\(m_{Fe}=0,2.56=11,2\left(g\right)\)
Fe + 2HCl →FeCl2 +H2
\(C\%=\dfrac{11,2}{18,25}.100\%=61,3\%\)

\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
a) Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
0,2 0,4 0,2 0,2
b) \(n_{HCl}=\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
⇒ \(m_{HCl}=0,4.36,5=14,6\left(g\right)\)
\(C_{ddHCl}=\dfrac{14,6.100}{100}=14,6\)0/0
c) \(n_{ZnCl2}=\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
⇒ \(m_{ZnCl2}=0,2.136=27,2\left(g\right)\)
\(m_{ddspu}=13+100-\left(0,2.2\right)=112,6\left(g\right)\)
\(C_{ZnCl2}=\dfrac{27,2.100}{112,6}=24,16\)0/0
Chúc bạn học tốt
\(n_{Zn}=\dfrac{13}{65}=0.2\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.2........0.4..........0.2.......0.2\)
\(m_{HCl}=0.4\cdot36.5=14.6\left(g\right)\)
\(C\%_{HCl}=\dfrac{14.6}{100}\cdot100\%=14.6\%\)
\(m_{ZnCl_2}=0.2\cdot136=27.2\left(g\right)\)
\(m_{\text{dung dịch sau phản ứng}}=13+100-0.2\cdot2=112.6\left(g\right)\)
\(C\%_{ZnCl_2}=\dfrac{27.2}{112.6}\cdot100\%=24.1\%\)

`a)PTHH:`
`Zn + 2HCl -> ZnCl_2 + H_2`
`0,2` `0,4` `0,2` `0,2` `(mol)`
`n_[Zn]=13/65=0,2(mol)`
`b)V_[H_2]=0,2.22,4=4,48(l)`
`c)m_[dd HCl]=[0,4.36,5]/5 . 100=292(g)`
`=>C%_[ZnCl_2]=[0,2.136]/[13+292-0,2.2].100~~8,93%`

Fe+2HCl->FeCl2+H2
0,125--0,25---0,125-0,125
m HCl=9,125 g=>n HCl=\(\dfrac{9,125}{26,5}\)=0,25 mol
=>m Fe=0,125.56=7g
=>VH2=0,125.22,4=2,8l
=>C%FeCl2=\(\dfrac{0,125.127}{7+182,5-0,25}\).100=8,388%

a) 2Al + 6HCl -> 2AlCl3 + 3H2
Al2O3 + 6HCl -> 2AlCl3 + 3H2O
nH2 = 0,15mol => nAl=0,1mol => mAl=2,7g; mAl2O3 = 10,2g => nAl2O3 = 0,1mol
=>%mAl=20,93% =>%mAl2O3 = 79,07%
b) nHCl = 0,1.3+0,1.6=0,9 mol=>mHCl(dd)=100g
mddY=12,9+100-0,15.2=112,6g
mAlCl3=22,5g=>C%=19,98%


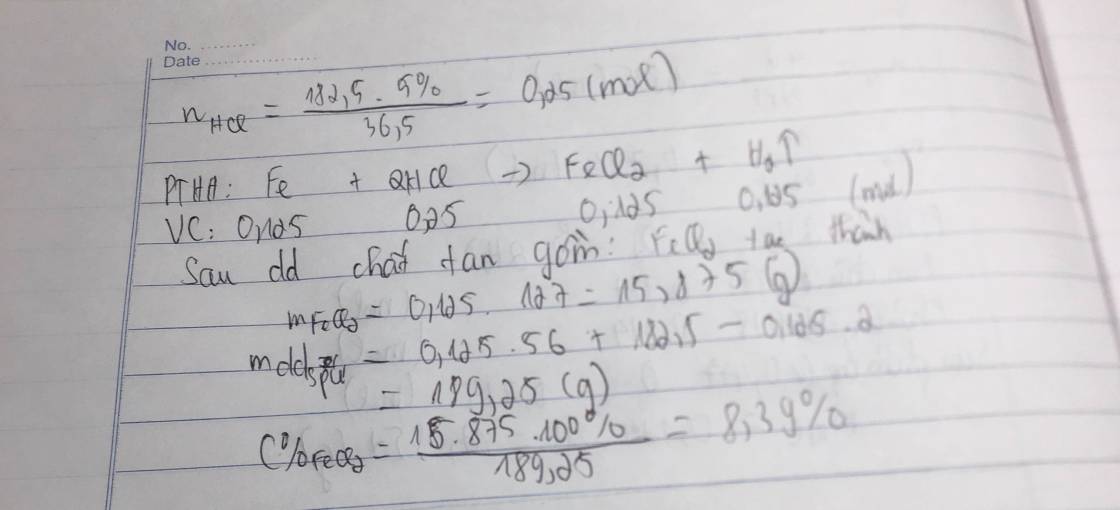
nCuO=16/80=0,2(mol)
a) PTHH: CuO + 2HCl-> CuCl2 + H2O
0,2__________0,4________0,2(mol)
b) mHCl=0,4.36,5=14,6(g)
=>mddHCl=(14,6.100)/20=73(g)
c) mCuCl2= 135.0,2=27(g)
mddCuCl2= mCuO + mddHCl= 16+73=89(g)
=> C%ddCuCl2=(27/89).100=30,337%
Câu 9 : Số mol của đồng (II) oxit
nCuO = \(\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{16}{80}=0,2\left(mol\right)\)
a) Pt : CuO + 2HCl → CuCl2 + H2O\(|\)
1 2 1 1
0,2 0,4 0,2
b) Số mol của axit clohidric
nHCl = \(\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
Khối lượng của axit clohidric
mHCl = nHCl . MHCl
= 0,4 . 36,5
= 14,6 (g)
Khối lượng của dung dịch axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{14,6.100}{20}=73\left(g\right)\)
c) Số mol cuả đồng (II) clorua
nCuCl2 = \(\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
Khối lượng của đồng (II) clorua
mCuCl2 = nCuCl2 . MCuCl2
= 0,2. 135
= 27 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mCuO + HCl
= 16 + 73
= 89 (g)
Nồng độ phần trăm của đồng (II) clorua
C0/0CuCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{27.100}{89}=30,34\)0/0
Chúc bạn học tốt