Hòa tan hoàn toàn 10.6g Na2CO3 vào nước được 200ml dung dịch Na2CO3 . Tính nồng độ phần trăm và nồng độ mol của dung dịch trên. Biết khối lượng riêng của dung dịch là 1.05g/ml
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Na_2CO_3}=\dfrac{10,6}{106}=0,1\left(mol\right)\\ \rightarrow C_{M\left(Na_2CO_3\right)}=\dfrac{0,1}{0,2}=0,5M\)
Ta có: \(C\%=\dfrac{C_M.M}{10.D}\)
\(\rightarrow C\%=\dfrac{0,5.106}{10.1,05}=5,05\%\)

Ta có: \(m_{dd}=300\cdot1,05=315\left(g\right)\) \(\Rightarrow C\%_{Na_2CO_3}=\dfrac{15,9}{315}\cdot100\%\approx5,05\%\)
Mặt khác: \(n_{Na_2CO_3}=\dfrac{15,9}{106}=0,15\left(mol\right)\) \(\Rightarrow C_{M_{Na_2CO_3}}=\dfrac{0,15}{0,3}=0,5\left(M\right)\)

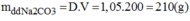
Nồng độ phần trăm của dung dịch pha chế:
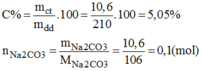
Nồng độ mol của dung dịch:
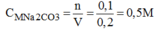

\(n_{Na_2CO_3}=\dfrac{21,2}{106}=0,2\left(mol\right)\)
=> \(C_M=\dfrac{0,2}{0,3}=0,667M\)
\(m_{dd}=300.1,05=315\left(g\right)\)
=> \(C\%=\dfrac{21,2}{315}.100\%=6,73\%\)

1ml dung dịch cho khối lượng 1,05 gam
200 ml dung dịch cho khối lượng m dd = 210 gam
Nồng độ phần trăm:
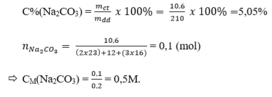

1ml dung dịch cho khối lượng 1,05 gam
200 ml dung dịch cho khối lượng mdd = 210 gam
Nồng độ phần trăm:
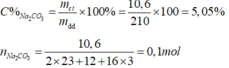
C M Na 2 CO 3 = 0 , 1 : 0 , 2 = 0 , 5 M .

Bài 1:
\(2Na+2H_2O\rightarrow2NaOH+H_2\\ n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ n_{Na}=n_{Na_2O}=0,2.2=0,4\left(mol\right)\\ a.m_{Na}=0,4.23=9,2\left(g\right)\\ b.C_{MddA}=\dfrac{0,4}{0,5}=0,8\left(M\right)\\ C\%_{ddA}=\dfrac{0,4.40}{500.1,2}.100\approx2,667\%\)
Khối lượng dung dịch \(Na_2CO_3\) là:
\(m_{Na_2CO_3}=V.D=200.10,5=210\left(g\right)\)
Nồng độ phần trăm của dung dịch trên là:
C%=\(\dfrac{m_{ct}}{m_{dd}}.100\%=\dfrac{10.6}{210}.100\%=5,05\%\)
Đổi 200ml=0,2l
Số mol của 10,6g \(Na_2CO_3\) là :
\(n_{Na_2CO_3}=\dfrac{m_{Na_{2_{ }}CO_3}}{M_{Na_2CO_3}}=\dfrac{10,6}{106}=0,1\left(mol\right)\)
Nồng độ mol của dung dịch trên là :
\(C_M=\dfrac{n}{V}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
Vậy\(C\%=5,05\%\\ C_M=0,5M\)