Cho m1 gam hỗn hợp gồm CuO và Cu có tỷ lệ số mol là 1:2 phản ứng vừa đủ với dung dịch H2SO4 đặc nóng. Sau phản ứng thu được m2 gam muối và 4,48 lít khí SO2. Tính m = m1 + m2.
A. 20,8 gam.
B. 48 gam.
C. 68,8 gam.
D. 58 gam.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi $n_{Fe} = a(mol) ; n_{FeO} = b(mol) \Rightarrow 56a + 72b = 36,8(1)$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
$2FeO + 4H_2SO_4 \to Fe_2(SO_4)_3 + SO_2 + 4H_2O$
Theo PTHH :
$n_{SO_2} = 1,5a + 0,5b = 15,68 : 22,4 = 0,7(2)$
Từ (1)(2) suy ra a = 0,4 ; b = 0,2
$n_{Fe_2(SO_4)_3} = (a + b).0,5 = 0,3(mol)$
$m_{Fe_2(SO_4)_3} = 0,3.400 = 120(gam)$

Đáp án A
Kết thúc phản ứng còn dư lại m1 (g) chất rắn Z
=> Z là Cu, dd Y gồm FeCl2 và CuCl2.
Fe3O4 + 8HCl → 2FeCl3 + FeCl2
0,01<---- 0,08 ------> 0,01
=> n C u = 0,02
2FeCl3 + Cu → 2FeCl2 + CuCl2
0,02 -----> 0,01 --> 0,02
=> n C u dư = 0,01 => m1 = 6,4g
dd Y tác dụng với A g N O 3
Ag+ + Cl- → AgCl
0,08 <--- 0,08 ----> 0,08
Fe2+ + Ag+ → Fe3+ + Ag
0,03 → 0,03
=> m2 = 0,03.108 + 0,08.143,5 = 14,72g

Chọn đáp án A
Quy đổi M{Axit X + Axit Y + Este Z} ![]()
nKOH = nCOO Þ nC2H5COOH sau khi quy đổi = 0,08
nKOH = nCOO Þ nC2H5COOH sau khi quy đổi = 0,08
Ta có tổng số mol hỗn hợp = nAxit + nEste = (0,08 - 2a) + a = 0,08 - a 0,08
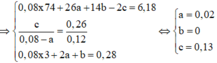
b = 0 nên X và Y đều chứa 3 cacbon Þ Tối đa chỉ có thể có 2 liên kết p trong gốc hiđrocacbon
Þ X là HCºC-COOH và Y là H2C=CH-COOH Þ 2 muối
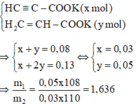
Giải thích quá trình quy đổi: Với chất Z ta có thể tách đuôi ancol C2H2 ra còn lại axit X và Y, viết gọn là: RCOO-C2H4-OOCR'= RCOOH + R'COOH + C2H2. Còn X và Y là axit không no nên ít nhất cũng chứa 3C trong phân tử Þ cả 2 đều được tạo thành từ ba thành phần: C2H5COOH + CH2 – H2
Đặt: nCuO=x(mol); nCu=2x(mol) (x>0)
CuO + H2SO4(đ) -to-> CuSO4 + H2O
0,1__0,1___________0,1(mol)
Cu + 2 H2SO4 (đ) -to-> CuSO4 + SO2 + 2 H2O
0,2_____0,4______0,2_________0,2(mol)
V(SO2,đktc)=4,48(l) => nSO2=4,48/22,4=0,2(mol)
=> nCu=0,2(mol) => nCuO= 0,1(mol)
m1= 0,1. 80 + 0,2. 64= 20,8(g)
m2= (0,1+0,2).160=48(g)
=>m1+m2=20,8+48=68,8(g)
=>CHỌN C