Đốt cháy 3,25 g một mẫu lưu huỳnh không tinh khiết trong khí oxi dư , người ta thu được 2,24 lít khí sunfurơ (đktc)
a) VIết phương trình hóa học
b) Bằng cách nào ta có thể tính được độ tinh khiết của mẫu lưu huỳnh đã dùng
c) Căn cứ vào PTHH trên , ta có thể trả lời ngay được thể tích khí oxi (đktc) vừa đủ để đốt cháy lưu huỳnh là bào nhiêu lít

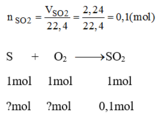
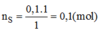
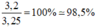

a) S + O2 \(\rightarrow\) SO2
b) Tính độ tinh khiết bằng cách lấy lượng lưu huỳnh tinh khiết(tức là lượng lưu huỳnh tham gia phản ứng ) chia cho lượng lưu huỳnh đề bài cho nhân với 100% . Mình giải luôn nhé!
nSO2 = V/22,4 = 2,24/22,4 =0,1(mol)
Theo PT => nS = nSO2 = 0,1(mol)
=> mS(tinh khiết) = n .M = 0,1 x 32 = 3,2(g)
=> độ tinh khiết của mẫu lưu huỳnh đã dùng = mS(tinh khiết) : mS(ĐB) x 100% = 3,2/3,25 x 100% =98,46%
c) Theo PT thấy nO2 = nSO2
mà số mol = nhau dẫn đến thể tích cũng bằng nhau
=> VO2 = VSO2 = 2,24(l)