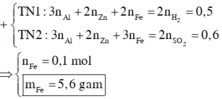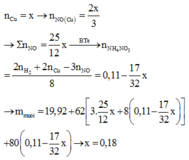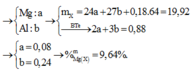Cho a gam hỗn hợp A gồm AL,Fe,Cu tác dụng với H2SO4 loãng dư thu được 952 ml H2. Mặt khác cho 2a gam hỗn hợp A tác dụng với NaOH dư thấy còn lại 3.52 gam kim loại không tan . Cho 3a hỗn hợp A tác dụng với 400 ml dung dịch HNO3 1.3 M thấy giải phóng V lít khí NO duy nhất và được dung dịch D . Lượng HNO3 dư trong dung dịch D hòa tan vừa hết 1 gam CaCO3 . tính số gam mỗi kim loại trong A và tính V . biết thể tích khí đo ở đktc .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

TN1: Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
2FeCl3 + Cu → CuCl2 + 2FeCl2
Vì Cu còn dư 0,1 mol nên sau phản ứng chứa FeCl2 : 3a mol, CuCl2 : a mol
→ a. 232 + 64. ( a + 0,1)= 24,16 → a = 0,06 mol
Vậy X gồm Cu: 0,16 mol và Fe3O4 : 0,06 mol
+ Nhận thấy nếu chất rắn chỉ chứa NaNO2 : 0,12 mol thì mchất rắn = 0,12. 69 > 78,16 gam.
⇒ Chất rắn chứa đồng thời NaNO2 : x mol và NaOH : y mol
Giả sử sản phẩm khử chứa N và O
Bảo toàn nguyên tố N → nN = 1,2 - 1,04 = 0,16 mol
Bảo toàn electron → 2nCu + nFe3O4 = 5nN - 2nO → nO = 0,21 mol
Bảo toàn khối lượng → mdd = 24,16 + 240 - 0,16.14 - 0,21. 16 = 258,56 gam
%Cu(NO3)2 =0.16*188/258,56 . 100% = 11,63%

Trong \(20,4g\) hỗn hợp có: \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow65a+56b+27c=20,4\left(1\right)\)
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45mol\)
\(BTe:2n_{Zn}+2n_{Fe}+3n_{Al}=2n_{H_2}\)
\(\Rightarrow2a+2b+3c=2\cdot0,45\left(2\right)\)
Trong \(0,2mol\) hhX có \(\left\{{}\begin{matrix}Zn:ka\left(mol\right)\\Fe:kb\left(mol\right)\\Al:kc\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow ka+kb+kc=0,2\)
\(n_{Cl_2}=\dfrac{6,16}{22,4}=0,275mol\)
\(BTe:2n_{Zn}+3n_{Fe}+3n_{Al}=2n_{Cl_2}\)
\(\Rightarrow2ka+3kb+3kc=2\cdot0,275\)
Xét thương:
\(\dfrac{ka+kb+kc}{2ka+3kb+3kc}=\dfrac{0,2}{2\cdot0,275}\Rightarrow\dfrac{a+b+c}{2a+3b+3c}=\dfrac{4}{11}\)
\(\Rightarrow3a-b-c=0\left(3\right)\)
Từ (1), (2), (3)\(\Rightarrow\left\{{}\begin{matrix}a=0,1mol\\b=0,2mol\\c=0,1mol\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{Zn}=6,5g\\m_{Fe}=11,2g\\m_{Al}=2,7g\end{matrix}\right.\)

Đáp án : A
nH2 = 0,25 mol; nSO2 = 0,3 mol
2H+ + 2e → H2 S+6 + 2e → S+4
0,5 <-- 0,25 0,6 <-- 0,3
nFe = 0,6 – 0,5 = 0,1 mol
=> mFe = 5,6g

Đáp án B
Chất rắn m1 là Cu. Bảo toàn e có 2nCu=3nNO
→ 2b = 2V/70
Gọi số mol: Mg là x; Cu là y; Al là z và NH4NO3 là t
Ta có hệ phương trình
(1) 2x +3y = 2n(H2) = 0,88
(2) 24x + 64y + 27z = 19,92
(3) 148x + 188y + 213z + 80t = 97,95
(4) 2x + 2y + 3t = 3n(NO) + 8n(NH4NO3) = 3V/22,4 + 8t = 6,25y + 8t
→ x = 0,08; y = 0,18; z = 0,24
→ %Mg = 9,64%

Chất rắn m1 là Cu. Bảo toàn e có 2nCu=3nNO
→ 2b = 2V/70
Gọi số mol: Mg là x; Cu là y; Al là z và NH4NO3 là t
Ta có hệ phương trình
(1) 2x +3y = 2n(H2) = 0,88
(2) 24x + 64y + 27z = 19,92
(3) 148x + 188y + 213z + 80t = 97,95
(4) 2x + 2y + 3t = 3n(NO) + 8n(NH4NO3) = 3V/22,4 + 8t = 6,25y + 8t
→ x = 0,08; y = 0,18; z = 0,24
→ %Mg = 9,64% → Đáp án B