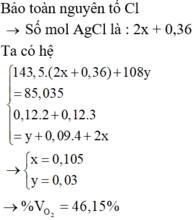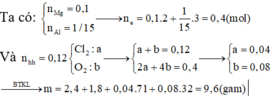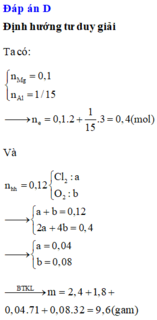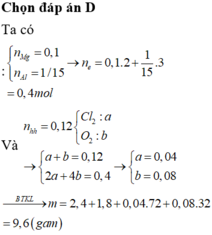Cho m gam hỗn hợp Ca và Mg cháy hoàn toàn trong lượng vừa đủ 6,72 lít (đktc) hỗn hợp khí gồm O2, Cl2 có tỉ khối so với H2 là 29. Khi pứ kết thúc thu đc 31,8 g sản phẩm rắn gồm các oxit và muối clorua của 2 kim loại. Xác định giá trị m. Tính % khối lượng các kim loại trong hỗn hợp ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D:
Gọi x, y lần lượt là số mol của Cl2 và O2 có trong 0,2 mol hỗn hợp khí Y =>x+y = 0,2(1)
Theo định luật bảo toàn khối lượng:
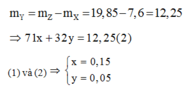
Gọi a, b lần lượt là số mol của Mg và Ca
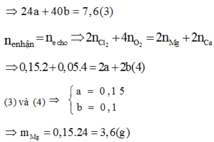

Đáp án D
Có

m g X + HNO3 đặc nguội → 0,1 mol NO2
→ BTe a . n M = 0 , 1 m o l ( 2 )
Từ (1) và (2) suy ra:
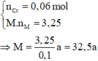
=> a = 2, M = 65 (M là Zn).

Đáp án C
nMg=nFe=9,6/(24+56)=0,12 mol
nO=nH+/2=0,36/2=0,18 mol => nO2=0,09 mol
nCl2=z
Giả sử trong Y:
Fe2+: x
Fe3+: y
Cl-: 2z+0,36 (BTNT Cl)
Fe2+ + Ag+ → Fe3+ + Ag
x x
Ag+ + Cl- → AgCl
2z+0,36 2z+0,36
BTNT Fe: x+y=0,12 (1)
BT e: 0,12.2+2x+3y=2z+0,18.2 (2)
m kết tủa = 108x+143,5(2z+0,36) = 85,035 (3)
Giải hệ pt ta được: x=0,03; y=0,09; z=0,105
%VO2=0,09/(0,09+0,105)=46,15%

Bạn ơi cho mình hỏi tại sao pt thứ 2 lại là 2a +4b vậy bạn giải thích chỗ đó giúp mik vs