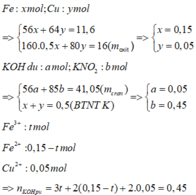a) Cần hoà tan 213g P2O5 vào bao nhiêu gam nước để đc dd H3PO4 49%
b) Nung hỗn hợp X gồm CaCO3 và CaSO3 tới pứ hoàn toàn thu đc chất rắn Y có khối lượng bằng 50,4% khối lượng của X. Thành phần % khối lượng CaCO3 trong X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử nCaCO3 = 1 mol
Đặt nCaSO3= x
CaCO3 → CaO + CO2
CaSO3 → CaO + SO2
chất rắn B có khối lượng bằng 50,4% khối lượng của A
⇒ 56(1+x) = 50,4%.( 100 +120x)
⇒ x = 1,25
⇒ mCaSO3 = 150g ⇒ mA = 250g
⇒ %mCaSO3 = ( 150 : 250).100% = 60%
%mCaCO3 = 40%
Đáp án B.

Mỗi phần, n R2CO3 = a(mol) ; n RHCO3 = b(mol)
Phần 1
$R_2CO_3 + Ba(OH)_2 \to BaCO_3 + 2ROH$
$RHCO_3 + Ba(OH)_2 \to BaCO_3 + 2ROH + H_2O$
n BaCO3 = a + b = 21,67/197 = 0,11(1)
Phần 2 : Nếu nung hoàn toàn
$2RHCO_3 \xrightarrow{t^o} R_2CO_3 + CO_2 + H_2O$
n CO2 = n H2O = 0,5b(mol)
=> m giảm = 44.0,5b + 18.0,5b = 3,41(2)
Từ (1)(2) suy ra a = 0; b = 0,11
=> Loại
Chứng tỏ ở phần 2, khi nhiệt phân muối thì R2CO3 có phản ứng
Chứng tỏ hai muối cần tìm là (NH4)2CO3 và NH4HCO3
$(NH_4)_2CO_3 \xrightarrow{t^o} 2CO_2 + H_2O + 2NH_3$
$NH_4HCO_3 \xrightarrow{t^o} CO_2 + NH_3 + H_2O$
Ta có : 96a + 79b = 28,11/3 = 9,37(3)
Từ (1)(3) suy ra a = 0,04 ; b = 0,07
Phần 3 :
$(NH_4)_2CO_3 + 2KOH \to K_2CO_3 + 2NH_3 + 2H_2O$
$2NH_4HCO_3 + 2KOH \to K_2CO_3 + 2NH_3 + 3H_2O$
n KOH = 2a + b = 0,15(mol)
=> V KOH = 0,15/1 = 0,15(lít) = 150(ml)

80 gam dung dịch A chứa 3,52 gam NaOH
=> 200 gam dung dịch A chứa 3,52.200/80 = 8,8 gam
n NaOH = 8,8/40 = 0,22(mol)
Gọi n Na = a(mol) ; n Na2O = b(mol)
=> 23a + 62b = 6,02(1)
$2Na + 2H_2O \to 2NaOH + H_2$
$Na_2O + H_2O \to 2NaOH$
n NaOH = a + 2b = 0,22(2)
Từ (1)(2) suy ra a= 0,1 ; b = 0,06
n H2 = 0,5a = 0,05(mol)
=> m H2O = 200 + 0,05.2 - 6,02 =194,08(gam)
%m Na = 0,1.23/6,02 .100% = 38,2%
%m Na2O = 100% -38,2% = 61,8%

Đáp án B
Trong T có KNO3
KN O 3 → t 0 KN O 2 + 0,5 O 2
Nếu trong T không có KOH, vậy khối lượng chất rắn thu được sau khi nhiệt phân T là khối lượng của KNO2.
mKNO2 = 0,5. 85 = 42,5 > 41,05
=> T gồm KOH dư và KNO2