một hợp chất có thành phần phân theo khối lượng là 35,96% S ; 62,92% O và 1,12% H . Hợp chất này có công thức hóa học là gì ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


đặt CT là HxSyOz
theo bài ta có tỉ lệ:
x:y:y=%1.12/1:%62.92/16:%35.96/32
=1.12:3.9325:1.12375
NẾU ĐẮT CT nguyên(HxSyOz)n
theo tỉ lệ x:y:z như trên
ta biện luận
với n=1.n=2.hoặc n=3..........
thay vào ta có:
n=2 thỏa yêu cầu bài cho
rút tỉ lệ với n=2 ta đc:2:7:2(chú ý bạn nên lấy số lớn nhất chia cho số nhỏ nhất sẽ ra)

C đúng.
Gọi CT hợp chất là HxSyOz
Ta có x : y : z = 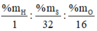 = 1,12 : 1,12 : 3,935 = 2 : 2 : 7
= 1,12 : 1,12 : 3,935 = 2 : 2 : 7
⇒ CT: H2S2O7

Câu 1:
a) Al2O3:
Phần trăm Al trong Al2O3: \(\%Al=\dfrac{27.2}{27.2+16.3}.100=52,94\%\)
Phần trăm O trong Al2O3: \(\%O=100-52,94=47,06\%\)
b) C6H12O:
Phần trăm C trong C6H12O: \(\%C=\dfrac{12.6}{12.6+12+16}.100=72\%\)
Phần trăm H trong C6H12O: \(\%H=\dfrac{1.12}{12.6+12+16}.100=12\%\)
Phần trăm O trong C6H12O : \(\%O=100-72-12=16\%\)
Câu 2:
\(m_H=\dfrac{5,88.34}{100}\approx2\left(g\right)\)
\(m_S=\dfrac{94,12.34}{100}=32\left(g\right)\)
\(n_H=\dfrac{m}{M}=\dfrac{2}{1}=2\left(mol\right)\)
\(n_S=\dfrac{m}{M}=\dfrac{32}{32}=1\left(mol\right)\)
⇒ CTHH của hợp chất: H2S

Gọi công thức chung là FexSyOz
%O2=48%
x:y:z=\(\dfrac{28}{56}:\dfrac{24}{32}:\dfrac{48}{16}=0,5:0,75:3=2:3:12\)
=> CTHH Fe2(SO4)3
tên: Sắt (III)sunfat