Từ 3 tấn quặng pirit sắt FeS2 (chứa 5% tạp chất) người ta điều chế được bao nhiêu tấn dung dịch H2SO4 98%. Biết hiệu suất của cả quá trình là 80%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(m_{FeS_2}=0.6\left(tấn\right)=0.6\cdot10^3\left(kg\right)\)
\(n_{FeS_2}=\dfrac{0.6\cdot10^3}{120}=\dfrac{10^3}{200}\left(kmol\right)\)
Dựa vào sơ đồ phản ứng :
\(n_{H_2SO_4}=2n_{FeS_2}=2\cdot\dfrac{10^3}{200}=\dfrac{10^3}{100}=10\left(kmol\right)\)
\(m_{H_2SO_4\left(tt\right)}=10\cdot\dfrac{98}{80\%}=1225\left(kg\right)\)
\(m_{dd_{H_2SO_4}}=\dfrac{1225}{98\%}=1250\left(kg\right)=12.5\left(tấn\right)\)
\(m_{FeS_2}=\dfrac{1.60}{100}=0,6\left(tấn\right)\)
=> \(m_{FeS_2\left(pư\right)}=\dfrac{0,6.80}{100}=0,48\left(tấn\right)\)
Cứ 1 mol FeS2 điều chế được 2 mol H2SO4
=> 120g FeS2 điều chế được 196g H2SO4
=> 0,48 tấn FeS2 điều chế được 0,784 tấn H2SO4
=> \(m_{ddH_2SO_4}=\dfrac{0,784.100}{98}=0,8\left(tấn\right)\)

Đáp án A.
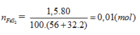
FeS2 → 2H2SO4 (Bảo toàn S)
0,01 → 0,02 (mol)
Do hiệu suất là 80%

Đáp án C.
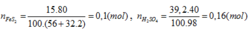
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%

a) 4 FeS2 + 11 O2 -to-> 2 Fe2O3 + 8 SO2
SO2+ 1/2 O2 -to,xt-> SO3
SO3+ H2O -> H2SO4
mFeS2= 0,58. 3=1,74(tấn)
m(H2SO4, lí thuyết)=(98.1,74)/480=0,35525(tấn)
Vì: H=70% -> mH2SO4(TT)=0,35525.70%=0,248675(tấn)
=> mddH2SO4= (0,248675.100)/98=0,25375(tấn)=253,75(kg)
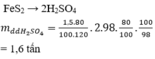

ôi t làm nhầm....kq là
3,8 tấn ( cân bằng thêm 2 vào h2so4 là okok)
FeS2 ==> H2SO4
120g 98g
2,85( vì 5% tạp chất) 2,3275 (tấn)
vì H=80% ====> m H2SO4=1,3965( tấn). nhưng có C% H2SO4= 98%
VẬY mdd H2S04 là 1,425 tấn