cho 6,5 kẽm vào bình dung dịch chứa 0,25 mol axit clohidric .
a/ tính thể tích khí hidro thu được ở đktc
b/ sau phản ứng còn dư chất nào ? khối lượng là bao nhiêu gam
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\n_{HCl}=0,25\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,25}{2}\) \(\Rightarrow\) HCl còn dư, Kẽm p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2}=0,1\left(mol\right)\\n_{HCl\left(dư\right)}=0,05\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=22,4\cdot0,1=2,24\left(l\right)\\m_{HCl\left(dư\right)}=0,05\cdot36,5=1,825\left(g\right)\end{matrix}\right.\)

Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
nZn = \(\dfrac{6,5}{65}=0,1mol\)
nHCl = \(\dfrac{60.7,3\%}{36,5}=0,12mol\)
Lập tỉ lệ: nZn : nHCl = \(\dfrac{0,1}{1}:\dfrac{0,12}{2}=0,1:0,06\)
=> Zn dư
nZn dư = 0,1 - 0,06 = 0,04 mol
=> mZn dư = 0,04 . 65 = 2,6g
\(n_{Zn}=\dfrac{6.5}{65}=0.1\left(mol\right)\)
\(n_{HCl}=\dfrac{60\cdot7.3}{100\cdot36.5}=0.12\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(1...........2\)
\(0.1.........0.12\)
\(LTL:\dfrac{0.1}{1}>\dfrac{0.12}{2}\Rightarrow Zndư\)
\(n_{H_2}=\dfrac{0.12}{2}=0.06\left(mol\right)\)
\(V_{H_2}=0.06\cdot22.4=1.344\left(l\right)\)
\(m_{Zn\left(dư\right)}=\left(0.1-0.06\right)\cdot65=2.6\left(g\right)\)

\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(n_{HCl}=\dfrac{14,6}{36,5}=0,4mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 < 0,4 ( mol )
0,1 0,2 0,1 ( mol )
Chất dư là HCl
\(n_{HCl\left(dư\right)}=0,4-0,2=0,2mol\)
\(V_{H_2}=0,1.22,4=2,24l\)

nZn=0,1 mol
nHCl=0,25 mol
Zn +2HCl=>ZnCl2+H2
Pứ 0,1 mol>=0,2 mol. =>0,1 mol
Dư 0,05 mol
VH2=2,24lit
HCl còn dư:0,05 mol
=>mHCl dư=1,825g

a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, \(n_{Fe_2O_3}=\dfrac{6,4}{160}=0,04\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,04}{1}< \dfrac{0,2}{3}\), ta được H2 dư.
Theo PT: \(n_{H_2\left(pư\right)}=3n_{Fe_2O_3}=0,12\left(mol\right)\Rightarrow n_{H_2\left(dư\right)}=0,2-0,12=0,08\left(mol\right)\)
\(\Rightarrow m_{H_2\left(dư\right)}=0,08.2=0,16\left(g\right)\)
Theo PT: \(n_{Fe}=2n_{Fe_2O_3}=0,08\left(mol\right)\Rightarrow m_{Fe}=0,08.56=4,48\left(g\right)\)

a: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
b: \(n_{Al}=\dfrac{2.5}{27}< \dfrac{1}{4}\)
=>H2SO4 dư, Al đủ
\(m_{H_2SO_4}=0.25\cdot98=24.5\left(g\right)\)
c: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{2.5}{54}=\dfrac{5}{108}\left(mol\right)\)
\(\Leftrightarrow n_{H_2}=\dfrac{5}{36}\left(mol\right)\)
\(V_{H_2}=\dfrac{5}{36}\cdot22.4=\dfrac{28}{9}\left(lít\right)\)
Mình thấy bạn Thịnh tính lượng dư sai
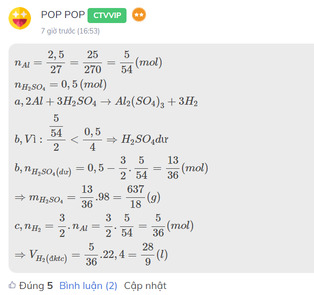
Đây là bài mình từng làm, bạn tham khảo nhé!

a)\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
b)\(n_{CuO}=\dfrac{12}{80}=0,15mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,15 0,1 0 0
0,1 0,1 0,1 0,1
0,05 0 0,1 0,1
\(CuO\) dư và dư 0,05mol
\(\Rightarrow m_{CuOdư}=0,05\cdot80=4g\)
a.\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,1 ( mol )
\(V_{H_2}=n_{H_2}.22,4=0,1.22,4=2,24l\)
b.\(n_{CuO}=\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{12}{80}=0,15mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,15 < 0,1 ( mol )
Chất còn dư là \(CuO\)
\(m_{CuO\left(du\right)}=n_{CuO\left(du\right)}.M_{CuO}=\left(0,15-0,1\right).80=4g\)
zn+2Hcl→zncl2+h2
a) nZn=6.5/65=0.1(mol)
ta có nZn/1=0.1/1<nHcl/2=0.25/2=0.125
→zn hết ,hcl dư
theo pt:nH2=nZn=0.1 (mol)
Vh2=0.1*22.4=2.24
b) sau pư zn hết ,Hcl dư
theo pt nHcl=2nZn=0.1*2=0.2( mol )
sô mol Hcl dư là:
0.25-0.2=0.05(mol)
mHcl dư là:0.05*36.5=1.825
xong