hằng số cân bằng của phản ứng thuận nghịch bậc 1 là 10. hằng số tốc độ phản ứng thuận bằng 0,2 phút ^-1. xác định thời gian để phản ứng đạt trạng thái cân bằng nếu tại thời điểm đầu chưa có sản phẩm phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


(1) Đúng
(2) Đúng, xúc tác làm tăng tốc độ cả phản ứng thuận và nghịch
(3) Đúng do phản ứng thuận nghịch phản ứng xảy ra không hoàn toàn, tại thời điểm cân bằng luôn có mặt chất phản ứng và chất sản phẩm
(4) Sai do nồng độ các chất không đổi thì phản ứng tiến tới trạng thái cân bằng
(5) Sai do cân bằng là cân bằng động nên phản ứng vẫn xảy ra, tốc độ phản ứng thuận và nghịch là bằng nhau
Chọn B

Đáp án B
(1) Đúng
(2) Đúng, xúc tác làm tăng tốc độ cả phản ứng thuận và nghịch
(3) Đúng do phản ứng thuận nghịch phản ứng xảy ra k hoàn toàn, tại thời điểm cân bằng luôn có mặt chất pu và chất sp
(4) Sai do nồng độ các chất k đổi thì phản ứng tiến tới trạng thái cân bằng
(5) Sai do cân bằng là cân bằng động nên phản ứng vẫn xảy ra, tốc độ phản ứng thuân và nghịch là bằng nhau
Chọn B

1) đúng
2) đúng
3) đúng
4) sai, nồng độ các chất sẽ không thay đổi ở trạng thái cân bằng (ở đây giả thiết các điều kiện khác không đổi)
5) sai, ở trạng thái cân bằng, phản ứng thuận và nghịch tiếp tục, nhưng nồng độ các chất đều không đổi
Đáp án A

Đáp án A
1, đúng
2, đúng
3, đúng
4, sai, nồng độ các chất sẽ không thay đổi ở trạng thái cân bằng (ở đây giả thiết các điều kiện khác không đổi)
5, sai, ở trạng thái cân bằng, phản ứng thuận và nghịch vẫn tiếp tục, nhưng nồng độ các chất đều không đổi.
=> Đáp án A

Đáp án B
Phản ứng thuận nghịch : Là phản ứng mà trong điều kiện xác định có thể đồng thời xảy ra theo hai chiều ngược nhau
Cân bằng hóa học : Là trạng thái của hệ phản ứng thuận nghịch , tại đó tốc độ phản ứng thuận và nghịch bằng nhau .
Do đó, các phát biểu sai là: a,c,e
Chọn B

Phản ứng thuận nghịch : Là phản ứng mà trong điều kiện xác định có thể đồng thời xảy ra theo hai chiều ngược nhau
Cần bằng hóa học : Là trạng thái của hệ phản ứng thuận nghịch, tại đó tốc độ phản ứng thuận và nghịch bằng nhau .
Do đó, các phát biểu sai là: a,c,e
Chọn B

Chọn C.
(3) Sai, vì cân bằng hóa học là trạng thái mà ở đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch nên luợng chất trước và sau phản ứng không thay đổi.
(5) Sai, vì khi phản ứng đạt trạng thái cân bằng thì phản ứng vẫn tiếp diễn nhưng với tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.

Ta có: Kcb \(=\) \(\dfrac{\text{k}_{\text{t }}}{\text{k}_{\text{n}}}\) \(\Rightarrow\) kn \(=\dfrac{\text{k}_{\text{t }}}{\text{K}_{\text{cb}}}=\dfrac{1,6.10^{-6}}{1,12}=1,43.10^{-6}\left(s^{-1}\right)\)
A \(⇌\) B
t = 0 a 0 (mol/l)
t \(a-x_{\infty}\) \(x_{\infty}\) (mol/l)
Vì thời gian để A còn lại 70% không phụ thuộc vào cách biểu diễn nồng độ
\(\Rightarrow\) Chọn a = 1 (mol/l)
Lại có: \(K_{cb}=\dfrac{k_t}{k_n}=\dfrac{[B]}{[A]}=\dfrac{x_{\infty}}{a-x_{\infty}}=1,12\)
\(\Leftrightarrow\dfrac{x_{\infty}}{1-x_{\infty}}=1,12\Leftrightarrow x_{\infty}=0,53\) (mol/l)
Thời gian để A còn lại 70% là:
\(t=\dfrac{1}{k_t+k_n}ln\dfrac{x_{\infty}}{x_{\infty}-x}=\dfrac{1}{1,6.10^{-6}+1,43.10^{-6}}ln\dfrac{0,53}{0,53-0,3}=2,75.10^5\left(s\right)\)
#TúHoàngVũ
#HUST
#VĩnhLạc1

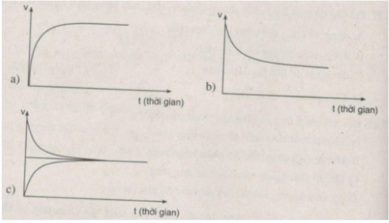
Đồ thị a biểu diễn sự biến đổi tốc độ phản ứng thuận theo thời gian.
Đồ thị b biểu diễn sự biến đổi tốc độ phản ứng nghịch theo thời gian.
Đồ thị c biểu diễn trạng thái cân bằng hoá học.