Cho hỗn hợp 2kim loại Fe và Cu vào dung dịch HCl dư,sau phản ứng thu được 1,12lit khí đktc a, viết ptpư hh sảy ra b, tính khối lượng Fe tham gia phản ứng ::cho Fe=56;Cu=64;H=1;Cl=35,5
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Mg + 2HCl \to MgCl_2 + H_2$
b) Gọi $n_{Al} = a(mol) ; n_{Mg} = b(mol) \Rightarrow 27a + 24b = 7,5(1)$
Theo PTHH : $n_{H_2} = 1,5a + b = \dfrac{7,84}{22,4} = 0,35(2)$
Từ (1)(2) suy ra : a = 0,1 ; b = 0,2
$\%m_{Al} = \dfrac{0,1.27}{7,5}.100\% = 36\%$
$\%m_{Mg} = 100\% - 36\% = 64\%$

a, Cho thử quỳ tím:
- Chuyển xanh -> NaOH
- Không đổi màu -> NaCl, Na2SO4 (1)
Cho các chất (1) tác dụng với BaCl2:
- Xuất hiện kết tủa trắng -> Na2SO4
Na2SO4 + BaCl2 -> 2NaCl + BaSO4
- Không hiện tượng -> NaCl

a) Xuất hiện chất rắn màu nâu đỏ, dung dịch chuyển dần từ xanh lam sang trắng xanh
$Fe + CuSO_4 \to FeSO_4 + Cu$
b) Xuất hiện vẩn đục màu trắng
$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$

Đáp án + Giải thích các bước giải:
(1) 4Al + 3O2 → 2Al2O3 (dưới nhiệt độ)
(2) Al2O3 + 3NaOH → 2NaAlO2 + H2O
(3) NaAlO2 + 2H2O + CO2 → Al(OH)3↓ + NaHCO3
(4) 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
(5) Al2(SO4)3 + BaCl2 → AlCl3 + BaSO4
(6) AlCl3 + 3AgNO3 → 3AgCl↓ + Al(NO3)3
(7) 4Al(NO3)3 → 2Al2O3 + 12NO2↑ + O2↑
(8) 2Al2O3 → 4Al + 3O2↑
Cho mình gửi chúc bạn học tốt! Nhớ vote cho mình 5 sao, 1 tim và câu trả lời hay nhất nha!^^
Mình làm hơi lâu mong bạn thông cảm:<
(1) 4Al + 3O2 → 2Al2O3 (dưới nhiệt độ)
(2) Al2O3 + 3NaOH → 2NaAlO2 + H2O
(3) NaAlO2 + 2H2O + CO2 → Al(OH)3↓ + NaHCO3
(4) 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
(5) Al2(SO4)3 + BaCl2 → AlCl3 + BaSO4
(6) AlCl3 + 3AgNO3 → 3AgCl↓ + Al(NO3)3
(7) 4Al(NO3)3 → 2Al2O3 + 12NO2↑ + O2↑
(8) 2Al2O3 → 4Al + 3O2↑

Gọi kim loại cần tìm là R
\(2R+3Cl_2\rightarrow2RCl_3\)
\(n_R=\dfrac{8,1}{M_R}\) (1)
\(n_{RCl_3}=\dfrac{40,05}{M_R+106,5}\) (2)
Theo PTHH: \(n_R=n_{RCl_3}\) (3)
Từ (1),(2) và (3) suy ra
\(\dfrac{8,1}{M_R}=\dfrac{40,05}{M_R+106,5}\)
\(\Rightarrow M_R=27\)
Vậy R là nhôm ( Al)
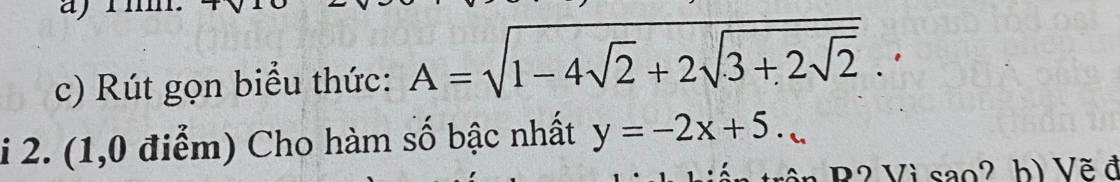
a) $Fe + 2HCl \to FeCl_2 + H_2$
b) Theo PTHH : $n_{Fe} = n_{H_2} = \dfrac{1,12}{22,4} = 0,05(mol)$
$\Rightarrow m_{Fe} = 0,05.56= 2,8(gam)$