trung hoà vừa đủ 500ml dung dịch BA(OH)2 1M(d=1,1g/ml) với 500gam dung dịch H2SO4 15%.Sau khi phản ứng kết thúc thấy tạo ra chất kết tủa màu trắng
Hãy:
a)Viết PTHH xảy ra
b)Tính khối lượng H2SO4 đã dùng
c)Tính khối lượng chất kết tủa thu được
d)Chất nào còn dư,tính nồng độ chất dư trong dung dịch sau phản ứng
(cho Ba=137, H=1, O=16, S=32)

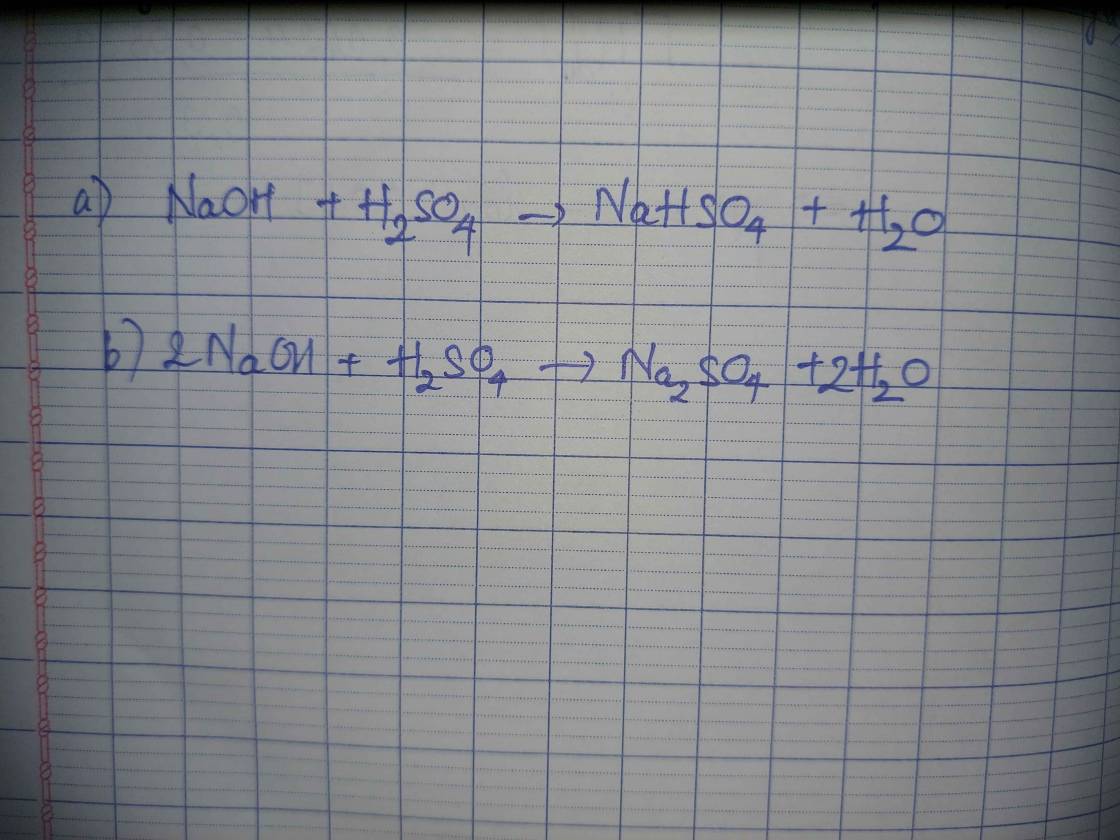
500ml=0.5l
nBaOH2 =0.5 x1=0.5 mol
MH2SO4=500.15%=75g
nH2SO4= xấp xỉ 0.8mol
H2SO4 dư tính theo BaOH2
pthh: Ba(OH)2 + H2SO4 => BaSO4+H2O
Theo pthh nBaSO4= nBa(OH)2=0.5mol
=>m kết tủa= 0.5x233=116.5g
theo pthh nH2SO4 phản ứng=nBaOH2= 0.5 mol
=> nH2SO4 Dư=0.8-0.5=0.3 mol
=>
m dư=0.3x98=29.4g
mH2SO4 đã dùng là m phản ứng? nếu thế thì m đã dung là 75-29.4=45.6
còn nếu m đã dùng là m chất tan thi là 75g như trên =))